အခုဆက္ၿပီး bonding ေတြအေၾကာင္းကို ေရးၾကည့္ပါမယ္။ အရမ္းကို လြယ္ကူေနရင္လညး္ ေက်ာ္သာသြားၾကပါ။ အေၿခခံမတင္ရေသးလုိ႔ အရင္တင္ၿဖစ္ေအာင္လို႔ အၿမန္ဆံုးေရးသားသြားပါ့မယ္။
ပထမဆံုး element ေတြ အကုန္လံုးကို စုထည့္ထားတဲ့ Periodic Table အေၾကာင္းစေၿပာပ့ါမယ္။ PTလို႔ပဲ ေခၚပါရေစ။ PTမွာ ေဒါင္လိုက္ ၇တန္းပါၿပီး အလ်ားလိုက္ ၇တန္းပါပါတယ္။ ေအာက္မွာ ပံုနွင့္တကြ ေဖာ္ၿပထားပါတယ္။ ံ
ံ
အဲဒီ periodic tableကိုပဲ electron ပါ၇ွိမွဳနဲ႔ ခြဲၿခားၿပထားတာကို ဆက္လက္ရွဳစားၾကည့္ပါ။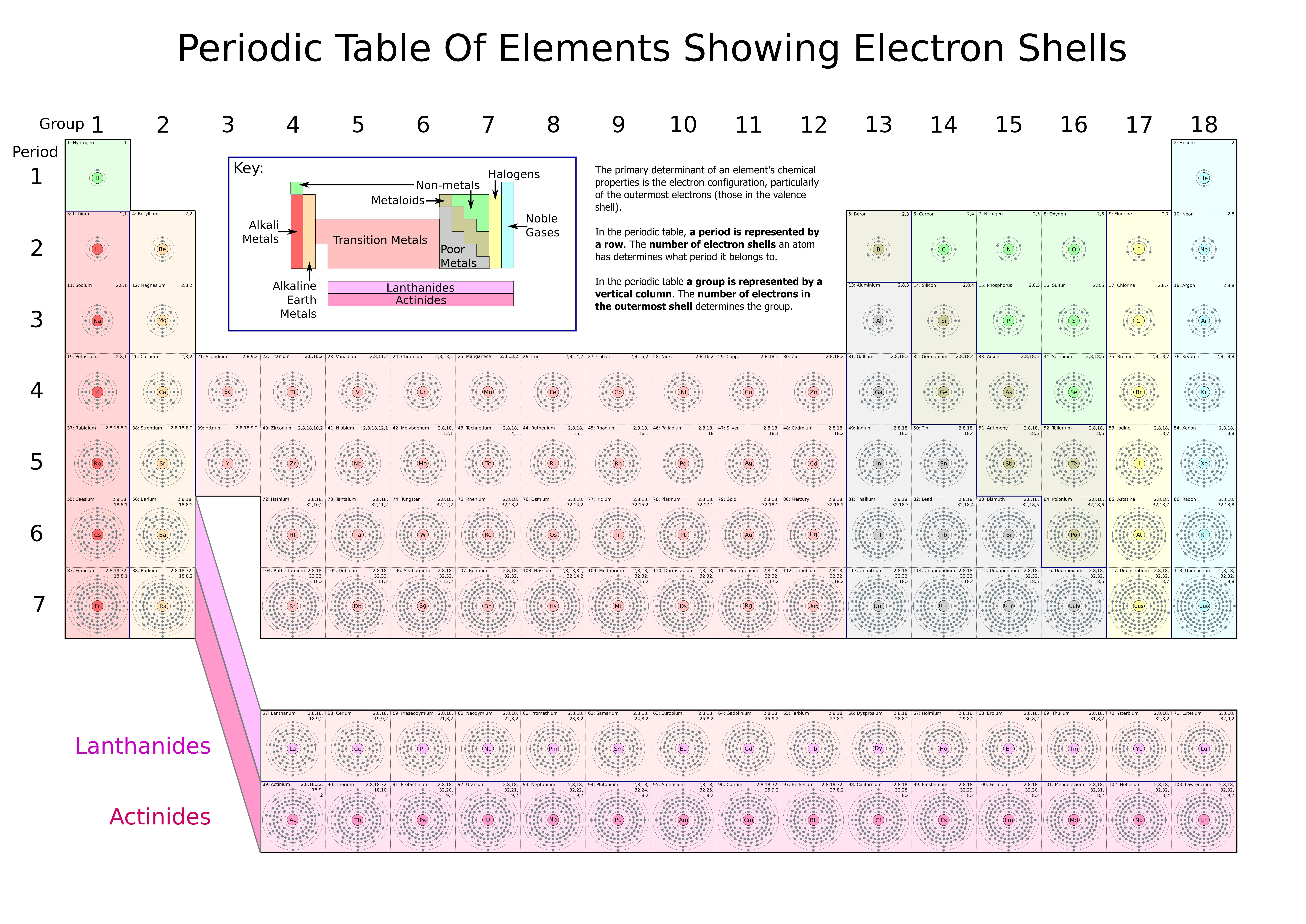 နည္းနည္းဆက္ရွင္းရင္ ေဒါင္လိုက္တန္း ေတြမွာ တူေနၾကတဲ့ element ေတြက အရည္အေသြးနဲ႔ သဘာ၀ေတြ တူညီၾကၿပီးေတာ့ အလ်ားလိုက္တန္းေတြမွာ တူညီတဲ့ element ေတြကေတာ့ အကာ အေရအတြက္ တူညီၾကပါတယ္။ ပထမဆံုး element နွစ္မ်ိဳးၿဖစ္တဲ့ Hydrogen နဲ႔ Helium ကလဲြရင္ က်န္တဲ့ element ေတြ အားလံုး shell အကာ တစ္ခုထက္ပုိၿပီး ပါၾကပါတယ္။ Periodic Table ဆိုတာ element ေတြကို စုစည္းထားၿခင္းသက္သက္ပါပဲ။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း periodic table ကို နားလည္ေလာက္ၿပီလိ႔ုထင္ပါတယ္။
နည္းနည္းဆက္ရွင္းရင္ ေဒါင္လိုက္တန္း ေတြမွာ တူေနၾကတဲ့ element ေတြက အရည္အေသြးနဲ႔ သဘာ၀ေတြ တူညီၾကၿပီးေတာ့ အလ်ားလိုက္တန္းေတြမွာ တူညီတဲ့ element ေတြကေတာ့ အကာ အေရအတြက္ တူညီၾကပါတယ္။ ပထမဆံုး element နွစ္မ်ိဳးၿဖစ္တဲ့ Hydrogen နဲ႔ Helium ကလဲြရင္ က်န္တဲ့ element ေတြ အားလံုး shell အကာ တစ္ခုထက္ပုိၿပီး ပါၾကပါတယ္။ Periodic Table ဆိုတာ element ေတြကို စုစည္းထားၿခင္းသက္သက္ပါပဲ။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း periodic table ကို နားလည္ေလာက္ၿပီလိ႔ုထင္ပါတယ္။
အခုေနာက္ပိုင္းမွာ element ေတြ တစ္ခုနဲ႔ တစ္ခု ဓာတ္ၿပဳပံုကို ေရးသားပါမယ္။ element ေတြကို သတၱဳ -metal၊ သတၱဳမဟုတ္ေသာ element မ်ား (ဘယ္လို ဗမာလို ေခၚရမွန္း မသိေတာ့လုိ႔ပါ :P) - nonmetals ၊ ေဟလိုဂ်င္ ဓာတ္ေငြ႔ - Halogen ဆုိၿပီး သံုးမ်ိဳး သံုးစားအၿပင္ ကန္႔လန္႔ အေၿခအေနမွာရွိတဲ့ element မ်ားကိုလည္း အမ်ိဳးအစားထပ္ခြဲလို႔ရပါေသးတယ္။ အေပၚက ပထမပံုကို ရွဳစားပါ။
ဒီဓာတ္ၿပဳမွဳက metal ေတြနဲ႔ non-metal ေတြ ၾကားမွာၿဖစ္ပါတယ္။ တခ်ိဳ႔ေသာ element ေတြရ႕ဲ႔electron ေတြက အၿပင္ဆံုး shell ထဲကို တစ္ခုတည္း ပို႔ထားသလို ပိုေနေစတတ္ပါတယ္။ အဲလိုပဲ တခ်ိဳ႔ေသာ element ေတြရဲ႕ ဖြဲ႕စည္းပံုက်ေတာ့လည္း shell တစ္ခုကုိ အၿပည့္အ၀မၿဖစ္ေစပဲ တစ္လံဳးတည္းေသာ electron သို႔ နွစ္လံဳးေသာ electron စသၿဖင့္ လုိေနေစပါတယ္။ အဲဒီလိုၿဖစ္ေနတဲ့အခါမွာ လိုအပ္တဲ့ electron ကို ေပးနုိင္တဲ့ ပိုလွ်ံေနတဲ့ element က လိုအပ္ေနတဲ့ element အနီးအနားကို ေရာက္သြားခဲ့လွ်င္၊ အကယ္ရ်္ တစ္ခုေသာ element က ေနာက္တစ္ခုထက္ပိုၿပီးေတာ့ ဆြဲငင္အား ေကာင္းခဲ့ရင္ အားနည္းၿပီး electron လညး္ပိုေနတဲ့ element က သူ႔ရဲ႕ ပိုေနတဲ့ electron ကို စြန္႔လႊတ္လိုက္ရပါတယ္။ အဲဒီလို စြန္႔လႊတ္လိုက္တဲ့အတြက္ နွစ္ခုလံုးေသာ element ေတြဟာ neutral မဟုတ္ေတာ့ပဲ လွ်ပ္စစ္ဓာတ္ကို ရရွိလာပါတယ္။ electron တစ္ခု ေပးလိုက္သူက အေပါင္းဓာတ္ကို သို႔ ဖိုဓာတ္ကို ရရွိၿပီး၊ ယူလိုက္သူက အနွုတ္ဓာတ္ သုိ႔ မဓာတ္ေတြကို ရလဒ္အၿဖစ္ ရရွိၾကပါတယ္။ အဲဒိလို ၿဖစ္သြားတဲ့အတြက္ element ႏွစ္ခုလံုးရဲ႕ elelctron တည္ၿမဲမွဳဟာ ပိုမို ခုိင္မာသြားပါတယ္။
ဒီတစ္မ်ိဳးကေတာ့ အေပၚက ionic bonding လို တစ္ဖက္က ပိုအားေကာင္းစရာမလိုေတာ့ပါဘူး။ ပုိေနတဲ့ electron ေတြကို တစ္ဘက္ဘက္က လံုး၀စြန္႔လႊတ္ဖို႔ မလုိေတာ့လို႔ပါ။ Covalent bonding ဟာ nonmetal နဲ႔ ဓာတ္ေငြ႔ ေတြမွာပဲ အမ်ားစု ၿဖစ္ေလ့ရွိတတ္ၾကပါတယ္။ element ႏွစ္ခု သုိ႔ နွစ္ခုထက္ပိုမိုပါ၀င္ၿပီး cavalent bonding ၿဖစ္နုိင္ပါတယ္။ နွစ္ခုလံုးေသာ atom ေတြဟာ shellကို ၿဖည့္စည္းဖုိ႔ electron တစ္လံုး သို႔ တစ္လံုးထက္ပိုမို ရွိေနရင္ အဲဒီ လုိအပ္ေနတဲ့ electron အေရအတြက္ကို မွ်တဖုိ႔ အတြက္ ေပါင္းစည္းနိုင္ၾကပါတယ္။ အဲဒီလို ေပါင္းစည္းလိုက္တဲ့အခါ အဲဒီ atom ႏွစ္ခုဟာ တစ္ပူးတည္း ၿဖစ္သြားၾကပါတယ္။ သဘာ၀အတိုင္း တည္ရွိေနၾကတဲ့ အရာအားလံုးဟာ covalent bond ေတြေၾကာင့္ ၿဖစ္လာၾကတာမ်ားပါတယ္။ ေအာက္မွာ နမူနာကို ပံုနဲ႔ ၿပထားပါတယ္။ Oxygen နဲ႔ Hydrogen ႏွစ္လံုး ေပါင္းစပ္လုိ႔ ေရၿဖစ္လာပံုပါ။

ဒီေလာက္ဆုိရင္ အဓိက ဓာတ္ၿပဳပံုနွစ္မ်ိဳးကို အက်ဥး္ခ်ဳပ္ ေဖာ္ၿပၿပီးၿပီလုိ႔ထင္ပါတယ္။ ေနာက္ထပ္ ဆြဲငင္အား နွစ္မ်ိဳး ( Van der Waals Force နဲ႔ Electrostatic Charge) တို႔ေၾကာင့္လည္း bonding ေတြ ၿဖစ္ လာ နုိင္ပါေသးတယ္။
အခုဆုိရင္ အလြန္အေၿခခံက်တဲ့ အရာမ်ားကို ေရးသားလုိ႔ ၿပီးသြားပါၿပီ။ ေနာက္တစ္ပို႔စ္မွာ သက္ရွိေတြအတြက္ အေရးအၾကီးဆံုး element တစ္ခု ၿဖစ္တဲ့ carbon အေၾကာင္း ဆက္ေ၇းပါ့မယ္။
(ဆက္၇န္)
0 comments:
Post a Comment