ကေန႔ကေတာ့ Isomer ေတြ အေၾကာင္းကို ဆက္ေၿပာပါ့မယ္။ Isomer ဆိုတာ ဖြဲ႔စည္းပံုတူၿပီးေတာ့ သ႑န္မတူတဲ့ ဓာတ္ေပါင္းေတြလုိ႔ ေၿပာခဲ့ဖူးပါတယ္။ အဲလို ဓာတ္ေပါင္းေတြ သ႑န္ကြဲၿပားေနတာကို Isomerism လုိ႔ေခၚပါတယ္။ Isomerism ေလးမ်ိဳးရွိပါတယ္ - Positional Isomerism, Skeletal Isomerism, Conformational Isomerism နဲ႔ Geometric Isomerism ပါ။ ေနာက္ဆံုး ႏွစ္ခု - Conformational Isomerism နဲ႔ Geometric Isomerism က Cyclo-alkane ေတြနဲ႔ပဲ သက္ဆုိင္ပါတယ္။
Saturday, October 3, 2009
O_o Basics 7 Isomers
Labels: Oh o, Organic Chemistry
Friday, October 2, 2009
O_o Basics- 6 hydrocarbons
ကေန႔မွာေတာ့ Organic Chemistry အေၿခခံကို စေ၇းပါမယ္။ Organic Chemistry အေၾကာင္းကို ေၿပာမယ္ဆိုရင္ Hydrocarbon ေတြ အေၾကာင္းက မပါလုိ႔မၿဖစ္ပါဘူး။ Organic compound ေတြအားလံုးကို Hydrocarbon ေတြနဲ႔ ဖြဲ႔စည္းထားတာမုိ႔ပါ။
Hydrocarbon ကို ႏွစ္မ်ိဳးနွစ္စား ခြဲလို႔ရပါတယ္ - unsaturated နဲ႔ saturated ပါ။ အလြယ္ဆံဳး ေၿပာရရင္ saturated ဆိုတာက ေမာ္လီက်ဴးေတြ အားလံုးၾကားမွာ single bond လုိ႔ ေခၚတဲ့ electron ႏွစ္လံုးကို မွ်ထားတဲ့ သေဘာရွိတဲ့ ဓာတ္ေပါင္းေတြကို ေခၚတာပါ။ unsaturated ဆိုတာကေတာ့ ဓာတ္ေပါင္းတစ္ခုမွာ double သုိ႔ triple bond ေတြ တစ္ခု သို႔ တစ္ခုထက္ပိုၿပီး ပါေနတာကို ေၿပာတာပါ။ saturated hydrocarbon က alkane တစ္မ်ိဳးတစ္စားပဲ ရွိေပမယ့္ unsaturated ကေတာ့ double နဲ႔ triple bond နွစ္မ်ိဳးရွိတဲ့အတြက္ alkene - double bond နဲ႔ alkyne - triple bond ဆိုၿပီး ႏွစ္မ်ိဳး ကြဲသြားပါတယ္။
Hydrocarbon ေတြကုိ နာမည္ေပးပံုက ရွင္းပါတယ္။ Saturated hydrocarbon (single bond ေတြပဲ ပါတဲ့ ဓာတ္ေပါင္းေတြ) ကိုဆုိရင္ --ane နဲ႔ အဆံုးသတ္ေပးၿပီး အေရွ႕ကေတာ့ ေရာမအကၡရာနံပါတ္ေတြကို Carbon ဘယ္နွလံုးပါလဲေပၚမူတည္ၿပီးေတာ့ ၿဖည့္စြက္ေပးပါတယ္။ ဥပမာ၊ Carbon ငါးလံုးပါရင္ ေရာမအကၡရာ ငါး က pentose အဲတာကို --ane နဲ႔ အဆံုးသတ္ေပးလိုက္ေတာ့ Pentane ၿဖစ္သြားပါတယ္။ Carbon ေၿခာက္လံုးပါရင္ ေရာမ အကၡရာ ေၿခာက္ - Hex ကိုယူၿပီး --ane ၿဖည့္ေပးလုိက္ပါတယ္။ အဲေတာ့ ဓာတ္ေပါင္းနာမည္က Hexane ပါ။ Unsaturated Hydrocarbon ေတြမွာေတာ့ အဆံုးသတ္ေတြက ကြဲၿပားပါတယ္။ double bond ေတြနဲ႔ ဖြဲ႔စည္းထားတဲ့ unsaturated hydrocarbon ေတြကို --ene နဲ႔ အဆံုးသတ္ေပးၿပီး triple bond ေတြနဲ႔ ဖြ႕ဲ႔စည္းထားတဲ့ ဓာတ္ေပါင္းေတြကိုေတာ့ --yne နဲ႔ အဆံုးသတ္ေပးပါတယ္။ ပါ၀င္တဲ့ Carbon အေရအတြက္ကိုေတာ့ ေရာမနံပါတ္ေတြနဲ႔ပဲ ေပးပါတယ္။
အဲဒီလို နာမည္ေပးနုိင္ဖို႔အတြက္ ေရာမ နံပါတ္ေတြကိုေတာ့ သိဖို႔ လိုပါလိမ့္မယ္။ ေအာက္ဘက္မွာ ေရာမ နံပါတ္ေတြကို လုိအပ္သလို အသံုးၿပဳနုိင္ဖို႔ ပံုနွင့္ေဖာ္ၿပထားပါတယ္။ Hydrocarbon အေၾကာင္းကို ေၿပာမယ္ဆိုရင္ Isomer အေၾကာင္းကိုလညး္ ေၿပာရပါလိမ့္မယ္။ Isomer ဆိုတာက Hydrocarbon ဓာတ္ေပါင္းတစ္မ်ိဳးတည္းကိုပဲ ဖြဲ႔စည္းပံု ပုံသ႑န္အရ ကြာၿခားေနတာကို သံုးတဲ့ အသံုးအႏွုန္းပါ။ ဥပမာၿပရရင္ saturated hydrocarbon တစ္မ်ိဳးၿဖစ္တဲ့ Propane ပါ။ အေပၚက ဇယားမွာ ၿပထားသလုိပဲ Propane မွာ Carbon သံုးလံုးပါပါတယ္။ ေဖာ္ၿမဴလာက C3H8 ပါ။ Propane ကို ရိုးရုိးရွင္းရွင္း ေဟာဒီလို တည္ေဆာက္လို႔ရပါတယ္။
Hydrocarbon အေၾကာင္းကို ေၿပာမယ္ဆိုရင္ Isomer အေၾကာင္းကိုလညး္ ေၿပာရပါလိမ့္မယ္။ Isomer ဆိုတာက Hydrocarbon ဓာတ္ေပါင္းတစ္မ်ိဳးတည္းကိုပဲ ဖြဲ႔စည္းပံု ပုံသ႑န္အရ ကြာၿခားေနတာကို သံုးတဲ့ အသံုးအႏွုန္းပါ။ ဥပမာၿပရရင္ saturated hydrocarbon တစ္မ်ိဳးၿဖစ္တဲ့ Propane ပါ။ အေပၚက ဇယားမွာ ၿပထားသလုိပဲ Propane မွာ Carbon သံုးလံုးပါပါတယ္။ ေဖာ္ၿမဴလာက C3H8 ပါ။ Propane ကို ရိုးရုိးရွင္းရွင္း ေဟာဒီလို တည္ေဆာက္လို႔ရပါတယ္။ အဲဒီလုိ မတည္ေဆာက္ပဲ ေနာက္တစ္နည္းနဲ႔ တည္ေဆာက္ၾကည့္မယ္ ဆုိရင္ ေဟာဒီလို ပံုသ႑န္ ထြက္ပါတယ္။
အဲဒီလုိ မတည္ေဆာက္ပဲ ေနာက္တစ္နည္းနဲ႔ တည္ေဆာက္ၾကည့္မယ္ ဆုိရင္ ေဟာဒီလို ပံုသ႑န္ ထြက္ပါတယ္။ ႏွစ္ခုလံုးမွာ Carbon နဲ႔ Hydrogen အေရအတြက္ အညီအမွ်ပဲ ပါၾကပါတယ္။ ေဖာ္ၿမဴလာကလည္း တူတူပါပဲ။ ဒါေပမယ့္ တကယ္တမ္း တည္ေဆာက္ၾကည့္လိုက္တဲ့အခါက်ေတာ့ ဓာတ္ေပါင္းဖြဲ႔ပံုက ႏွစ္မ်ိဳးကြဲသြားပါတယ္။ အဲဒီလုိ ကြဲၿပားေနတတ္တဲ့ နာမည္တူ၊ ပါ၀င္မွုညီမွ်တဲ့ ဓာတ္ေပါင္းေတြကို Isomer ေတြလို႔ ေခၚၾကပါတယ္။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း Isomer ကို သေဘာေပါက္ေလာက္ပါၿပီ။
ႏွစ္ခုလံုးမွာ Carbon နဲ႔ Hydrogen အေရအတြက္ အညီအမွ်ပဲ ပါၾကပါတယ္။ ေဖာ္ၿမဴလာကလည္း တူတူပါပဲ။ ဒါေပမယ့္ တကယ္တမ္း တည္ေဆာက္ၾကည့္လိုက္တဲ့အခါက်ေတာ့ ဓာတ္ေပါင္းဖြဲ႔ပံုက ႏွစ္မ်ိဳးကြဲသြားပါတယ္။ အဲဒီလုိ ကြဲၿပားေနတတ္တဲ့ နာမည္တူ၊ ပါ၀င္မွုညီမွ်တဲ့ ဓာတ္ေပါင္းေတြကို Isomer ေတြလို႔ ေခၚၾကပါတယ္။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း Isomer ကို သေဘာေပါက္ေလာက္ပါၿပီ။
Isomer ေတြ နဲ႔ ဓာတ္ေပါင္းဖြဲ႔စည္းပံု အေၾကာင္းေတြကို ေၿပာရင္းနဲ႔ ေနာက္ထပ္ထူးၿခားတာ တစ္ခုကိုဆက္ေၿပာပါ့မယ္။ တခါတရံက်ေတာ့ electron ဆြဲအားအရ အတည္ၿငိမ္ဆံုးသ႑န္ကို ဓာတ္ေပါင္းက ယူတဲ့အခါမွာ အ၀ိုင္းသ႑န္ bond ေတြ ၿဖစ္သြားတတ္ပါတယ္။ အဲဒီလုိ အခါမ်ိဳးက်ေတာ့ အဲဒီ ဓာတ္ေပါငး္ရဲ႕ နာမည္ေရွ႕႔မွာ cyclo- ဆိုတာကို ေပါင္းထည့္ေပးရပါတယ္။ ဥပမာ၊ Carbon ငါးလံုးပါတဲ့ pentane ဆုိရင္ cyclopentane ေပါ့။ အဲဒီလို မွည့္ေခၚရပါတယ္။ (*** cyclo-methane နဲ႔ cyclo-ethane ရယ္လုိ႔ မရွိပါဘူး။)
အခုဆိုရင္ Hydrocarbon ေတြအေၾကာင္း အေၿခခံအေတာ္မ်ားမ်ားကို ေဖာ္ၿပလုိ႔ ၿပီးသြားပါၿပီ။ ေနာက္တစ္ပို႔စ္က်ေတာ့မွပဲ Alkane, Alkene ေတြ အေၾကာင္းကို ဆက္ေ၇းပါ့မယ္။
(ဆက္ရန္)
Labels: Oh o, Organic Chemistry
O_o Basics- 5 Carbon
Carbon ဟာ ကမာၻေပၚက သက္ရွိေတြ အားလံုးအတြက္ အေရးပါတဲ့ element တစ္ခုပါ။ သက္ရွိသက္မဲ့ ကမာၻေပၚမွာ ရွိရွိသမွ် အရာအားလံုးနီးပါးကို C, H, O နဲ႔ N လုိ႔ေခၚတဲ့ Oxygen, Carbon, Hydrogen, Nitrogen တို႔နဲ႔ ဖြဲ႔စည္းထားပါတယ္။ သက္၇ွိေတြအားလံုး ဖြဲ႔စည္းထားတဲ့ ေမာ္လီက်ဴးေလးေတြကိုလည္း Carbon ပါတဲ့ bond ေတြအမ်ားစုနဲ႔ပဲ ဖြဲ႔စည္းထားပါတယ္။ သက္ရွိေတြရဲ႕ အစာအာဟာရကိုပဲၾကည့္ဦးမလား Carbon ပါပါတယ္။ အဲတာေၾကာင့္မုိ႔ Carbon အေၾကာင္းကို အခုလုိ တစ္ပုိ႔စ္ သပ္သပ္တင္ဖုိ႔ ၾကိဳးစားရတာပါ။
Carbon ရဲ႔ atomic number က ၁၂ ပါ။ သူ႔မွာ electron ၄ လံုးတိတိ အၿပင္ဘက္အက်ဆံုး orbit မွာပုိေနပါတယ္။ ဒါေၾကာင့္မုိ႔ bond ေလးခု ၿဖစ္တည္နိုင္ပါတယ္။ မ်ားေသာအားၿဖင့္ သဘာ၀အတုိင္းအရကေတာ့ H, O နဲ႔ N ေတြနဲ႔ပဲ ဓာတ္ၿပဳတတ္ပါတယ္။


 ကာဗြန္အေၾကာင္းကေတာ့ ဒီေလာက္ဆုိရင္ ေတာ္ေလာက္ၿပီလို႔ ယူဆပါတယ္။ ေနာက္တစ္ပို႔စ္မွာ organic chemistry အေၿခခံ အစစ္ေတြကို စပါမယ္။ အခုထိကေတာ့ ရိုးရိုး chemistry အေၿခခံေတြပဲ ရွိပါေသးတယ္။ (ဆက္ရန္)
ကာဗြန္အေၾကာင္းကေတာ့ ဒီေလာက္ဆုိရင္ ေတာ္ေလာက္ၿပီလို႔ ယူဆပါတယ္။ ေနာက္တစ္ပို႔စ္မွာ organic chemistry အေၿခခံ အစစ္ေတြကို စပါမယ္။ အခုထိကေတာ့ ရိုးရိုး chemistry အေၿခခံေတြပဲ ရွိပါေသးတယ္။ (ဆက္ရန္)Labels: Oh o, Organic Chemistry
O_o Basics- 4 Pi & Sigma
ေစာေစာကပို႔စ္က ေၿပာထားသလို ကာဗြန္ အေၾကာင္းကို ဆက္ေၿပာပါ့မယ္။ မေၿပာခင္မွာ bonding အေၾကာင္း နည္းနည္းက်န္ေသးတာကို ဆက္ေၿပာၿပပါ့မယ္။ ပို႔စ္၃ မွာ သဘာ၀အတုိင္းၿဖစ္တည္ေနသမွ် အရာအားလံုးဟာ covalent bond ေတြေၾကာင့္ခ်ည္း ၿဖစ္ၾကတယ္လို႔ ေၿပာခဲ့ဖူးပါတယ္။ Covalent bond ေတြမွာ တစ္ခုေသာ element က ပုိၿပီးေတာ့ ဆြဲငင္အား ေကာင္းတာမ်ိဳးကို ေတြ႔ရတတ္ပါတယ္။ အဲဒီအခါက်ေတာ့ electron ေတြဟာ ဆြဲငင္အားပိုသာတဲ့ဘက္ကို ပိုမိုနီးကပ္သြားတဲ့အတြက္ Polar bond ဆိုတာ ၿဖစ္ေပၚလာပါတယ္။ အဲလို ၿဖစ္လာရင္ formal charge ဆုိတာလည္း ၿဖစ္လာပါတယ္။ အမွန္ေတာ့ formal charge ဆိုတာ electron မွ်တာ သို႔ ေပးလွဴတာ သို႔ လက္ခံတာေတြေၾကာင့္ element မွာ ၿဖစ္ေပၚလာတ့ဲ လွ်ပ္စစ္ဓာတ္ပါ။ electron လက္ခံတဲ့ဘက္က အနုတ္လကၡဏာၿပၿပီး ေပးေ၀တဲ့ဘက္က အေပါင္းဓာတ္ကို ရပါတယ္။ electron မွာ အနုတ္ဓာတ္ (အမဓာတ္) ရွိလို႔ပါ။ အဲဒီလို ေနာက္ဆံုးရလဒ္အၿဖစ္ရတဲ့ လွ်ပ္စစ္ဓာတ္ (formal charge) ကို တြက္ခ်က္ၿပီး ထုတ္ယူလုိ႔ရပါတယ္။ ေဖာ္ၿမဴလာကေတာ့ -
=
group number - unshared electrons - half of shared electrons
မ်ားေသာအားၿဖင့္ Polar covalent bond ေတြမွာ အဲဒီ ရလဒ္ကို တြက္ထုတ္ဖုိ႔ လုိေလ့ရွိတတ္ပါတယ္။ Polar covalent bonding နွစ္မ်ိဳးရွိပါတယ္။ Sigma နဲ႔ Pi ပါ။ Sigma bonding ကေတာ့ ရွင္းပါတယ္။ S orbital ေတြက တစ္ခုနဲ႔တစ္ခု ထပ္ေနပါတယ္။ P orbital ဆုိရင္ေတာ့ ေက်ာခ်င္းကပ္ေနတတ္ၾကပါတယ္။ P orbital နဲ႔ S orbital ဆိုရင္ေတာ့ S orbital က P orbital ရဲ႕ ေခါင္းဘက္မွာ သြားထပ္ေနတတ္ပါတယ္။ ေအာက္မွာ ပံုနဲ႔ ရွင္းၿပထားပါတယ္။

ေနာက္တစ္ပို႔စ္မွာ Carbon အေၾကာင္းကို ဆက္ေရးပါ့မယ္။
(ဆက္ရန္)
Labels: Oh o, Organic Chemistry
Thursday, October 1, 2009
O_o Basics - 3
အခုဆက္ၿပီး bonding ေတြအေၾကာင္းကို ေရးၾကည့္ပါမယ္။ အရမ္းကို လြယ္ကူေနရင္လညး္ ေက်ာ္သာသြားၾကပါ။ အေၿခခံမတင္ရေသးလုိ႔ အရင္တင္ၿဖစ္ေအာင္လို႔ အၿမန္ဆံုးေရးသားသြားပါ့မယ္။
ပထမဆံုး element ေတြ အကုန္လံုးကို စုထည့္ထားတဲ့ Periodic Table အေၾကာင္းစေၿပာပ့ါမယ္။ PTလို႔ပဲ ေခၚပါရေစ။ PTမွာ ေဒါင္လိုက္ ၇တန္းပါၿပီး အလ်ားလိုက္ ၇တန္းပါပါတယ္။ ေအာက္မွာ ပံုနွင့္တကြ ေဖာ္ၿပထားပါတယ္။ ံ
ံ
အဲဒီ periodic tableကိုပဲ electron ပါ၇ွိမွဳနဲ႔ ခြဲၿခားၿပထားတာကို ဆက္လက္ရွဳစားၾကည့္ပါ။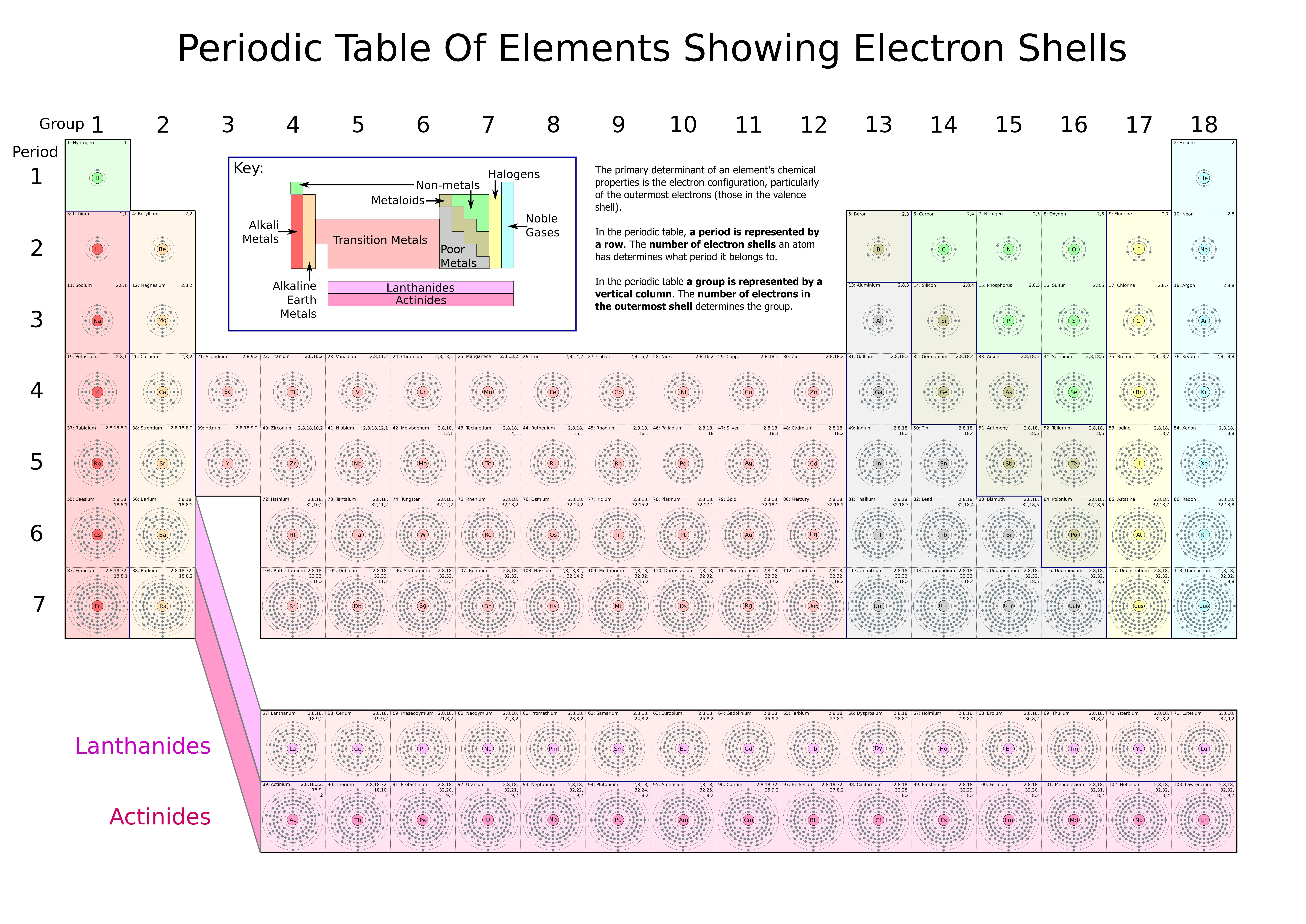 နည္းနည္းဆက္ရွင္းရင္ ေဒါင္လိုက္တန္း ေတြမွာ တူေနၾကတဲ့ element ေတြက အရည္အေသြးနဲ႔ သဘာ၀ေတြ တူညီၾကၿပီးေတာ့ အလ်ားလိုက္တန္းေတြမွာ တူညီတဲ့ element ေတြကေတာ့ အကာ အေရအတြက္ တူညီၾကပါတယ္။ ပထမဆံုး element နွစ္မ်ိဳးၿဖစ္တဲ့ Hydrogen နဲ႔ Helium ကလဲြရင္ က်န္တဲ့ element ေတြ အားလံုး shell အကာ တစ္ခုထက္ပုိၿပီး ပါၾကပါတယ္။ Periodic Table ဆိုတာ element ေတြကို စုစည္းထားၿခင္းသက္သက္ပါပဲ။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း periodic table ကို နားလည္ေလာက္ၿပီလိ႔ုထင္ပါတယ္။
နည္းနည္းဆက္ရွင္းရင္ ေဒါင္လိုက္တန္း ေတြမွာ တူေနၾကတဲ့ element ေတြက အရည္အေသြးနဲ႔ သဘာ၀ေတြ တူညီၾကၿပီးေတာ့ အလ်ားလိုက္တန္းေတြမွာ တူညီတဲ့ element ေတြကေတာ့ အကာ အေရအတြက္ တူညီၾကပါတယ္။ ပထမဆံုး element နွစ္မ်ိဳးၿဖစ္တဲ့ Hydrogen နဲ႔ Helium ကလဲြရင္ က်န္တဲ့ element ေတြ အားလံုး shell အကာ တစ္ခုထက္ပုိၿပီး ပါၾကပါတယ္။ Periodic Table ဆိုတာ element ေတြကို စုစည္းထားၿခင္းသက္သက္ပါပဲ။ ဒီေလာက္ဆုိရင္ စာဖတ္သူလည္း periodic table ကို နားလည္ေလာက္ၿပီလိ႔ုထင္ပါတယ္။
အခုေနာက္ပိုင္းမွာ element ေတြ တစ္ခုနဲ႔ တစ္ခု ဓာတ္ၿပဳပံုကို ေရးသားပါမယ္။ element ေတြကို သတၱဳ -metal၊ သတၱဳမဟုတ္ေသာ element မ်ား (ဘယ္လို ဗမာလို ေခၚရမွန္း မသိေတာ့လုိ႔ပါ :P) - nonmetals ၊ ေဟလိုဂ်င္ ဓာတ္ေငြ႔ - Halogen ဆုိၿပီး သံုးမ်ိဳး သံုးစားအၿပင္ ကန္႔လန္႔ အေၿခအေနမွာရွိတဲ့ element မ်ားကိုလည္း အမ်ိဳးအစားထပ္ခြဲလို႔ရပါေသးတယ္။ အေပၚက ပထမပံုကို ရွဳစားပါ။
ဒီဓာတ္ၿပဳမွဳက metal ေတြနဲ႔ non-metal ေတြ ၾကားမွာၿဖစ္ပါတယ္။ တခ်ိဳ႔ေသာ element ေတြရ႕ဲ႔electron ေတြက အၿပင္ဆံုး shell ထဲကို တစ္ခုတည္း ပို႔ထားသလို ပိုေနေစတတ္ပါတယ္။ အဲလိုပဲ တခ်ိဳ႔ေသာ element ေတြရဲ႕ ဖြဲ႕စည္းပံုက်ေတာ့လည္း shell တစ္ခုကုိ အၿပည့္အ၀မၿဖစ္ေစပဲ တစ္လံဳးတည္းေသာ electron သို႔ နွစ္လံဳးေသာ electron စသၿဖင့္ လုိေနေစပါတယ္။ အဲဒီလိုၿဖစ္ေနတဲ့အခါမွာ လိုအပ္တဲ့ electron ကို ေပးနုိင္တဲ့ ပိုလွ်ံေနတဲ့ element က လိုအပ္ေနတဲ့ element အနီးအနားကို ေရာက္သြားခဲ့လွ်င္၊ အကယ္ရ်္ တစ္ခုေသာ element က ေနာက္တစ္ခုထက္ပိုၿပီးေတာ့ ဆြဲငင္အား ေကာင္းခဲ့ရင္ အားနည္းၿပီး electron လညး္ပိုေနတဲ့ element က သူ႔ရဲ႕ ပိုေနတဲ့ electron ကို စြန္႔လႊတ္လိုက္ရပါတယ္။ အဲဒီလို စြန္႔လႊတ္လိုက္တဲ့အတြက္ နွစ္ခုလံုးေသာ element ေတြဟာ neutral မဟုတ္ေတာ့ပဲ လွ်ပ္စစ္ဓာတ္ကို ရရွိလာပါတယ္။ electron တစ္ခု ေပးလိုက္သူက အေပါင္းဓာတ္ကို သို႔ ဖိုဓာတ္ကို ရရွိၿပီး၊ ယူလိုက္သူက အနွုတ္ဓာတ္ သုိ႔ မဓာတ္ေတြကို ရလဒ္အၿဖစ္ ရရွိၾကပါတယ္။ အဲဒိလို ၿဖစ္သြားတဲ့အတြက္ element ႏွစ္ခုလံုးရဲ႕ elelctron တည္ၿမဲမွဳဟာ ပိုမို ခုိင္မာသြားပါတယ္။
ဒီတစ္မ်ိဳးကေတာ့ အေပၚက ionic bonding လို တစ္ဖက္က ပိုအားေကာင္းစရာမလိုေတာ့ပါဘူး။ ပုိေနတဲ့ electron ေတြကို တစ္ဘက္ဘက္က လံုး၀စြန္႔လႊတ္ဖို႔ မလုိေတာ့လို႔ပါ။ Covalent bonding ဟာ nonmetal နဲ႔ ဓာတ္ေငြ႔ ေတြမွာပဲ အမ်ားစု ၿဖစ္ေလ့ရွိတတ္ၾကပါတယ္။ element ႏွစ္ခု သုိ႔ နွစ္ခုထက္ပိုမိုပါ၀င္ၿပီး cavalent bonding ၿဖစ္နုိင္ပါတယ္။ နွစ္ခုလံုးေသာ atom ေတြဟာ shellကို ၿဖည့္စည္းဖုိ႔ electron တစ္လံုး သို႔ တစ္လံုးထက္ပိုမို ရွိေနရင္ အဲဒီ လုိအပ္ေနတဲ့ electron အေရအတြက္ကို မွ်တဖုိ႔ အတြက္ ေပါင္းစည္းနိုင္ၾကပါတယ္။ အဲဒီလို ေပါင္းစည္းလိုက္တဲ့အခါ အဲဒီ atom ႏွစ္ခုဟာ တစ္ပူးတည္း ၿဖစ္သြားၾကပါတယ္။ သဘာ၀အတိုင္း တည္ရွိေနၾကတဲ့ အရာအားလံုးဟာ covalent bond ေတြေၾကာင့္ ၿဖစ္လာၾကတာမ်ားပါတယ္။ ေအာက္မွာ နမူနာကို ပံုနဲ႔ ၿပထားပါတယ္။ Oxygen နဲ႔ Hydrogen ႏွစ္လံုး ေပါင္းစပ္လုိ႔ ေရၿဖစ္လာပံုပါ။

ဒီေလာက္ဆုိရင္ အဓိက ဓာတ္ၿပဳပံုနွစ္မ်ိဳးကို အက်ဥး္ခ်ဳပ္ ေဖာ္ၿပၿပီးၿပီလုိ႔ထင္ပါတယ္။ ေနာက္ထပ္ ဆြဲငင္အား နွစ္မ်ိဳး ( Van der Waals Force နဲ႔ Electrostatic Charge) တို႔ေၾကာင့္လည္း bonding ေတြ ၿဖစ္ လာ နုိင္ပါေသးတယ္။
အခုဆုိရင္ အလြန္အေၿခခံက်တဲ့ အရာမ်ားကို ေရးသားလုိ႔ ၿပီးသြားပါၿပီ။ ေနာက္တစ္ပို႔စ္မွာ သက္ရွိေတြအတြက္ အေရးအၾကီးဆံုး element တစ္ခု ၿဖစ္တဲ့ carbon အေၾကာင္း ဆက္ေ၇းပါ့မယ္။
(ဆက္၇န္)
Labels: Oh o, Organic Chemistry
O_o Basics-2
ေစာေစာက စာကို ၿပန္ဆက္ပါမယ္။ အဲဒီ atom ေတြက electron ေတြက nucleus ကို ၀ိုင္းပတ္ေနတယ္လုိ႔ ေစာေစာက ဆုိထားခဲ့ပါတယ္။ အဲဒီ electron ေတြက သူ႔ဘာသာသူ သြားခ်င္ရာသြားၿပီး ပတ္ခ်င္သလို ပတ္ေနတာ မဟုတ္ပါဘူး။ သူတုိ႔ဟာ nucleus ကို အနီးဆံုးကေန စပတ္ေနတဲ့ shell ၁ ကေန ၇ အထိ ခုနွစ္ခုတိတိ ေပၚမွာ တည္ၿပီး လွုပ္ရွားၾကရတာပါ။ အဲဒီ အကာတစ္ခုခ်င္းစီမွာ s ၊ p၊ d နဲ႔ f ဆိုတဲ့ orbit ေလးခုတိတိရွိပါတယ္။ အဲဒီ ေလးခုစလံုးမွာ သူတို႔ရဲ႕႔ ပံုသ႑န္ကိုယ္စီ electron ပါရွိနုိင္မွု ကိုယ္စီ ရိွၾကပါတယ္။ Orbit အၾကီးေတြက အေသးေတြကို အုပ္ၿပီး ၿဖစ္တည္ေနပါတယ္။
S က စက္လံုး (sphere) သ႑န္ လံုးလံုး၀ိုင္း၀ိုငး္ရွိပါသတဲ့။ P ကေတာ့ စက္လံုး သ႑န္ေပမယ့္လည္း အပိုင္းေလးနွစ္ခုပါပါတယ္။ နည္းနည္းေလးလည္း အ၀န္းက ပိုၾကီးသြားပါတယ္။ေအာက္မွာ ပံုနဲ႔ ၿပထားပါတယ္။
 ဒီက ယူထားပါတယ္
ဒီက ယူထားပါတယ္ေစာေစာက nucleus ကိုပတ္ထားတဲ့ အကာ (shell) ခုနစ္ခုရွိတယ္လုိ႔ ေၿပာခဲ့ပါတယ္။ အဲဒီ အကာေတြရဲ႕႔ ပထမဆံုးတစ္ခုမွာ S orbital တစ္ခုပဲ ပါပါတယ္။ Shell number 2 မွာေတာ့ S နဲ႔ P ႏွစ္ခုပါပါတယ္။ ေနာက္ Shell number 3 မွာေတာ့ S, P, D သံုးခုပါပါတယ္။ Shell number 4 ကမွ စလုိ႔ s,p,d,f ေလးခုလံုး အၿပည့္အစံု ပတ္ပါတယ္။ s မွာ electron ၂လံုး ၀င္နုိင္ပါတယ္။ p မွာ electron ၆ လံုး ၀င္နုိင္ပါတယ္။ Px, Py, Pz ဆိုၿပီး orbital အခြဲသံုးခုပါတာ အေပၚမွာ ေဖာ္ၿပထားခဲ့ပါၿပီ။ d မွာ electron ၁၀လံုး ၀င္နုိင္ပါတယ္။ orbital အခြဲတစ္ခုမွာ electron ၂လံုး စီ ၿဖည့္နုိင္တဲ့အတြက္ d orbital မွာ လက္ခြဲငါးခုပါတယ္လုိ႔ သတ္မွတ္လုိ႔ရနုိင္ပါတယ္။ f orbital မွာ electron ၁၄ လံဳး၀င္နုိင္ပါတယ္။
electron ေတြကို ေနရာခ်ပံုနဲ႔ ပတ္သတ္လို႔ Aufbau Principle ဆိုတာကို ဆက္၇ွင္းၿပပါမယ္။ Aufbau Principle က electron ေတြကို nucleus နဲ႔ အနီးဆံုး အကာကေန ၿပီးေတာ့ ၿဖည့္သြားတယ္လုိ႔ ဆုိပါတယ္။ orbital ေတြအကုန္လံုးကို တစ္လံုးစီ ၿဖည့္သြားလို႔ ၿပည့္သြားမွ ဆက္ၿပီးေတာ့ ဒုတိယတစ္လံုးကို ၿဖည့္ပါတယ္။ အဲဒီလိုၿဖည့္သြားလိုက္တာ အကာတစ္ခုၿပည့္မွ ေနာက္တစ္ခုကို ဆက္သြားပါတယ္။ ပံုနဲ႔ ရွင္းၿပတာက ပိုေကာင္းတယ္ ထင္မိလုိ႔ ပံုၿဖည့္ထားပါတယ္။ မွ်ားၿပထားတဲ့အတိုင္း electron ေတြကို စီသြားပါတယ္။

ေနာက္တစ္ပံုကို ပိုမိုရွင္းလင္းေစဖုိ႔ရာ ရည္ရြယ္ၿပီး ထပ္ၿဖည့္ထားပါတယ္။ ရွစားၾကည့္ပါ။ နားလည္ဖုိ႔ လြယ္ကူမယ္လုိ႔ ထင္မိပါတယ္။ electron ေတြကို ၿဖည့္ပံု ၿဖည့္နည္းပါ။

အခုဆုိရင္ အင္မတန္အေၿခခံက်တဲ့ atom သေဘာတ၇ားကိုေတာ့ ေ၇းလုိ႔ ၿပီးသေလာက္ရွိသြားပါၿပီ။ ေနာက္ထပ္ အေၿခခံ compound ေတြ အေၾကာင္းကို ဆက္ေရးပါ့မယ္။
(ဆက္ရန္)
Labels: Oh o, Organic Chemistry
Organics.. Organics! (O_o) Basics-1
ကေန႔ကေတာ့ မကိုင္တာ ၾကာတဲ့ Organic Chemistry ကို တို႔ၾကည့္ပါမယ္။ မွားတာရွိရင္ ေ၀ဖန္ေလကန္ ေၿပာဆိုဖို႔ ဖိတ္ေခၚပါတယ္။ အရင္တုန္းကလည္း မေရးဖူးေသးေတာ့ကာ အစကစေရးရမယ္လုိ႔ ထင္မိလုိ႔ အေၿခခံနည္းနည္းကို ေရးပါရေစ။

ေစာေစာကေၿပာေနတာေလးကို ၿပန္ဆက္ရမယ္ဆုိရင္ proton အေရအတြက္ဟာ electron အေရအတြက္နဲ႔ အၿမဲညီပါတယ္။ Atomic Number ဟာ proton သုိ႔ electron အေရအတြက္ကို ေခၚတာၿဖစ္ပါတယ္။ Mass Number ဆိုတာကေတာ့ proton နဲ႔ neutron အေရအတြက္ကို ေပါင္းထားတာၿဖစ္ပါတယ္။ Atom ေတြဟာ တစ္မ်ိဳးထဲကိုပဲ မူကြဲ နွစ္မ်ိဳးသံုးမ်ိဳး ရွိနုိင္ပါေသးတယ္။ အဲဒီ မူကြဲေတြကို သဘာ၀အတို္င္းေတြ႔ရရင္ Isotopes လို႔ေခၚပါတယ္။ Isotopes ေတြမွာ proton နဲ႔ electron အေရအတြက္ ညီတူညီမွ်ပါၿပီး neutronအေရအတြက္ေတာ့ ကြဲၿပားသြားပါတယ္။ Atomic Mass ကေတာ့ အဲဒီ Isotope ေတြအားလံုးကို ပ်မ္းမွ် ရွာထားတဲ့ အေရအတြက္တစ္ခုပါ။
(ဆက္ရန္)
Labels: Oh o, Organic Chemistry